SBHの原理 (Sodium Borohydride)
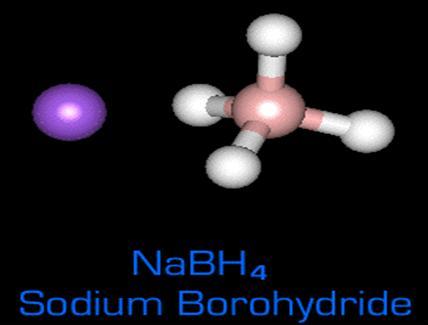
① SBH(NaBH4)とは

IUPAC名 水素化ホウ素ナトリウム
分子式 NaBH4
分子量 37.83
形状 白色固体結晶
密度 1.074gmc-3
融点 400℃
沸点 500℃
性質 :
・白色固体 300℃までは乾燥空気中で安定
・水素含有量 : 10.6wt%
・水と反応しやすく、水を分解し水素含有量の2倍の水素を発生する。
下記説明②、③を参照。
(左図 紫がナトリウム、ピンクがホウ素、白が水素)
② 高いエネルギー貯蔵性能

SBHは加水分解することで貯蔵エネルギーが倍増し極めて高い効率を示す。
③ 発電プロセス 「水の化学分解法」
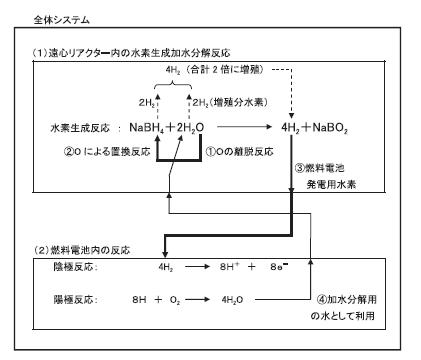
ボロハイドライド(NaBH4)の脱水素反応は,下記①式で示すように左辺が燃料となり、加水分解で
右辺の水素を生成します。この反応によりボロハイドライドに貯蔵された水素2分子と,水から
2分子の合計4分子の水素を作り出すことになります。
NaBH4 + 2H2O → 4H2↑ + NaBO2 ・・・・・①
水素化ホウ素ナトリウム メタホウ酸ナトリウム
Sodium Boro Hydoride:SBH
ソジウムボロハイドライド
この反応はボロハイドライド(NaBH4)の4Hが,水を構成している酸素O と置換反応をおこし
結合力が強いNaBO2に変化する際に,その水がOの脱離によりH2を生じる現象です。
このように,水を化学的に分解し水素を生成する方法を「水の化学分解法」と表現しています。
この「水の化学分解」は常温でもすでに臨界状態にあり活性化エネルギーゼロでも進行します。
その結果,水を分解して生じる2 H2が増殖分になります。その化学分解する2 H2Oは
燃料電池の+極に生成する4 H2Oを利用することにより,外部より供給する必要が無くなります。
その結果水素生成のwt%は21.2%になります。
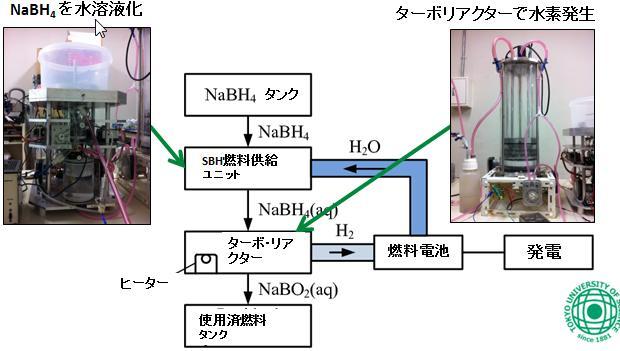
④「循環型加水分解」による水の効率利用
この「水の化学分解」は常温でもすでに臨界状態にあり活性化エネルギーゼロでも進行します。
その結果,水を分解して生じる2 H2が増殖分になります。その化学分解する
2 H2Oは燃料電池の+極に生成する
4 H2Oを利用することにより,外部より供給する必要が無くなります。
その結果水素生成のwt%は21.2%になります。
「燃料電池」は、水の加水分解を逆にしたものなので、水素と酸素を反応させ電気と水を発生させますが、この水の処理は燃料電池の一つの課題でもあります。
しかしSBHシステムではこの特性を逆に長所として利用し、燃料電池が生成する水を循環的に加水分解に利用することで(「循環型加水分解」)水素生成量を倍増することができます。
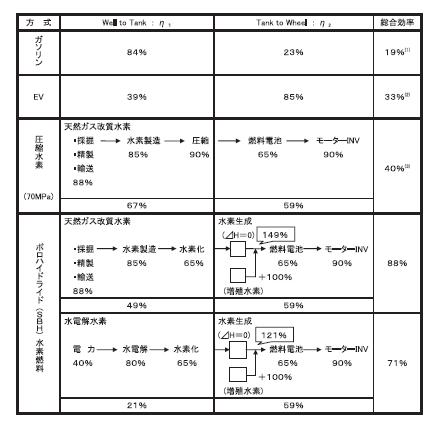
⑤ 高い総合エネルギー効率
これを発電直前(Tank to Wheel)で行うので、SBHシステムの総合効率は70-80%代に飛躍的に向上します。
SBHが下表のように他の水素吸着素材や蓄電池と比べ非常に高いエネルギー貯蔵率を持つのも、この「循環加水分解」
機能のはたらきが大きいと言えます。
バナースペース
アースプロジェクト株式会社
epts21@gmail.com
TEL 0798-77-3738
FAX 0798-55-9966